Encefalopatía Espongiforme Bovina
También conocida como: EEB - Enfermedad de las Vacas Locas
Introducción
La EEB fue reconocida por primera vez en Reino Unido en 1986 tras una gran epidemia en la que se vieron envueltos más de 100.000 animales enfermos. Con la excepción de Francia y Portugal, el número de animales infectados en otros países se ha mantenido bajo. La enfermedad está ahora distribuida por todo el mundo y existen datos de casos producidos en Europa, Asia, Oriente Medio y América del Norte.
La encefalopatía espongiforme bovina (EEB) es una enfermedad nerviosa progresiva, mortal y no febril que afecta a los bovinos adultos. Pertenece a un grupo de enfermedades llamadas encefalopatías espongiformes transmisibles (EET), también conocidas como enfermedades priónicas. Puede ser causada por una enfermedad genética o infecciosa. Se produce cuando la conformación de los priones naturales PrP se transforma en la isoforma patógena PrP sc y produce degeneración espongiosa del cerebro. En las enfermedades priónicas genéticas, este hecho puede ser causado por una mutación somática en el gen PrP c. En la encefalopatía espongiforme bovina infecciosa, la exposición a un prion PrP sc extraño puede iniciar este cambio de conformación, lo que da lugar a una cascada progresiva de cambios en la conformación de los priones naturales PrP c a PrP sc [1].
El ganado se infectó por primera vez con los priones anormales a través de la alimentación con piensos que contenían proteínas derivadas de ingredientes tales como harina de carne y huesos (HCH) procedentes de rumiantes. Se cree que los cambios en el proceso de fabricación de HCH aumentaba la supervivencia de materiales similares a scrapie (priones) de las canales de ovino infectadas y el uso de despojos infectados de la misma especie bovina pudo conducir a la propagación de la EEB a través de la HCH infectada.
No existen datos para afirmar la posibilidad de transmisión horizontal de la EEB en circunstancias naturales, pero hay datos que apoyan la transmisión vertical [2], [3], [4], [5], [6]. La EEB es una enfermedad de declaración obligatoria y a diferencia del scrapie se considera zoonosis.
Características
La enfermedad tiene un período de incubación muy largo (aproximadamente 4 - 5 años) y afecta principalmente a animales de 4-6 años de edad. La enfermedad ocasiona signos neurológicos que pueden durar varios meses y cuyo desenlace es la muerte. No hay predisposición de raza o sexo, sin embargo, la incidencia de la EEB en las vacas lecheras es mucho mayor que en las vacas de carne, probablemente este hecho esté relacionado con un mayor uso de raciones de concentrados que contienen harinas.
Las encefalopatías espongiformes también pueden presentarse en nuevas especies como el kudu mayor, Nyala, onynx árabe, oryx de cuernos en cimitarra, eland, Gemsbok, bisontes, Ankole, tigre, guepardo, ocelote, puma y gatos domésticos, durante la década de 1990 [7], [8] , [1] y en 2005 una cabra fue confirmada como positiva para la EEB en Francia. Hasta la fecha no hay evidencia científica de que la infección experimental vía oral de EEB sea un problema para cerdos y aves de corral alimentados con material de riesgo de ganado afectado por EEB.
Signos Clínicos
El primer signo suele ser separación de la manada y la reticencia a moverse en la sala de ordeño y los animales pueden reaccionar pateando de forma vigorosa.
Los afectados por EEB muestran progresivos cambios neurológicos y de comportamiento, anormalidades en la postura y el movimiento, postración, cambios en la sensibilidad y el temperamento y agresividad. Los signos clínicos más destacados son nerviosismo, temblores, caídas, hiperestesia al sonido y tacto, debilidad progresiva y ataxia de los miembros posteriores - y la agalaxia o disminución del rendimiento y de la producción.
Otros signos clínicos incluyen anorexia, pérdida de peso, bruxismo, ptialismo, trismo, prurito, córnea áspera y opaca, signos oftálmicos como la ceguera, lagrimeo, ptosis palpebral y prolapso del tercer párpado.
Diagnóstico
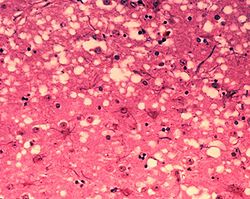
El diagnóstico preliminar se puede hacer basado en la observación de los signos clínicos anteriormente nombrados. La enfermedad se caracteriza por la acumulación de la proteína priónica en el bulbo raquídeo (obex), en regiones del cerebro, así como otros tejidos (ganglios linfáticos, bazo, amígdalas, etc) y puede ser confirmado en el diagnóstico post mortem por la presencia de los siguientes cambios histológicos en el cerebro: vacuolización bilateral y simétrica, y demostración inmunohistoquímica de la acumulación de la proteína específica de PrP sc en la materia gris del cerebro, gliosis, hipertrofia de astrocitos, degeneración neuronal y amiloidosis cerebral.
La ausencia de respuestas inmunes detectables en la EEB tiene como consecuencia la imposibilidad de realizar cualquier prueba serológica para la detección de anticuerpos.
Para la vigilancia de la enfermedad, se han desarrollado una serie de pruebas de diagnóstico rápido en muestras de cerebro que han sido aprobadas por la Unión Europea. Éstas incluyen la prueba de Western Blot (detección de PrPres), el inmunoensayo de luminiscencia (detección de proteínas específicas de la enfermedad por priones), y la prueba de ELISA de quimioluminiscencia.
Diagnóstico diferencial: hipomagnesemia, acetonemia nerviosa, envenenamiento por plomo, tumores intracraneales y enfermedades infecciosas como la rabia, listeriosis, enfermedad de Aujeszky y necrosis cerebro-cortical (CCN).
Tratamiento
Actualmente no existe una vacuna o protocolo de tratamiento para esta enfermedad.
Control
La EEB es extremadamente difícil de controlar debido a su largo período de incubación y al hecho de que los priones alterados son extremadamente resistentes al calor y productos químicos. Existen estrictas medidas de prevención puestas en marcha para detener la propagación de la enfermedad, evitar la exposición del ganado y la exposición humana y para erradicar la EEB en la población animal.
La medida más importante ha sido la prohibición de los piensos establecida en 1988, la prohibición del uso de carne de rumiantes y harina de huesos (HCH) como alimento para los propios rumiantes [9] y la adopción de esta prohibición en la UE en 1994.
Los planes de tests post-mortem y el sacrificio de animales de la cohorte infectados también han ayudado a reducir la propagación de la EEB. Hasta el momento esto ha desembocado en una disminución significativa del número de casos de EEB en el Reino Unido y otros países afectados. En la actualidad, el número de casos en el Reino Unido está disminuyendo.
Para los países que están libres de EEB, las medidas preventivas en rumiantes son la prohibición de la alimentación de rumiantes con productos procedentes de otros rumiantes, los controles en la importación y la vigilancia.
Para reducir el riesgo para los seres humanos de desarrollo de la enfermedad de Creutzfeldt-Jakob (vECJ), todos los nervios y tejido linfático visibles que se clasifican como materiales específicos de riesgo (MER), se eliminan durante el procesamiento del ganado, así como se eliminan los animales sospechosos de la cadena alimentaria humana.
El material específico de riesgo en bovinos incluye: cerebro, ojos (retina), ganglios del nervio trigémino, médula espinal, ganglios de la raíz dorsal, mesenterio, intestino (duodeno hasta el recto) y amígdalas.
El MER en el ganado ovino y caprino es: bazo, íleon, columna vertebral, cerebro, ojos y amígdalas.
En 1996, los bovinos mayores de 30 meses de edad fueron eliminados de la cadena alimentaria en el Reino Unido bajo el "'"régimen de más de treinta meses""' (OTMS). Esta prohibición se ha levantado y ahora es obligatorio someter a las diferentes pruebas de EEB a todos los bovinos mayores de 48 meses de edad.
Referencias
- ↑ 1,0 1,1 Prusiner, S.B. (1997) Prion diseases. In: Viral pathogenesis. Nathanson, et al., eds. Philadelphia, USA: Lippin-Cott-Raven Publishers, 871-911.
- ↑ Wilesmith, J.W., Ryan, J.B.M. (1997) Absence of BSE in the offspring of pedigree suckler cows affected by BSE in Great Britain. Veterinary Record, 141(10):250-251; 5 ref.
- ↑ Donnelly ,C.A. (1998) Maternal transmission of BSE: interpretation of the data on the offspring of BSE-affected pedigree suckler cows. Veterinary Record, 142(21):579-580; 9 ref..
- ↑ Fatzer, R., Ehrensperger, F., Heim, D., Schmidt, J., Schmitt, A., Braun, U., Vandevelde, M. (1998) Investigation of 182 offspring of cows with bovine spongiform encephalopathy (BSE) in Switzerland. Part 2. Epidemiological and neuropathological results. Schweizer Archiv für Tierheilkunde, 140(6):250-254; 14 ref.
- ↑ Schreuder BEC (1998) Epidemiological aspects of scrapie and BSE including a risk assessment study. ISBN 90-393-1636-8. Thesis University of Utrecht
- ↑ OIE (2000) Bovine spongiform encephalopathy. In: OIE Manual of Standards for diagnostic tests and vaccines. Office International des Epizooties (edition 4), 457-460.
- ↑ Benbow, G.M. (1990) Zoo animal BSE. Vet. Rec. 126:441.
- ↑ Collinge, J. (2001) Prion diseases of humans and animals: their causes and molecular basis. Ann. Rev. Neurosci. 24:519-550.
- ↑ Hoinville, L.J. (1994) Decline in the incidence of BSE in cattle born after the introduction of the 'feed ban'. Veterinary Record, 134(11):274-275; 12 ref.

|
Este artículo fue originalmente de The Animal Health & Production Compendium (AHPC) publicado en el web por CABI. Hoja(s) de datos utilizados: bovine spongiform encephalopathy el 30 May 2011 |
Enlaces
List of Member Countries' BSE risk status from the World Organisation for Animal Health (OIE)
| Este artículo ha sido revisado por pares, pero aún no ha sido evaluado por un experto. |
Este artículo ha sido traducido de Inglés por 'Raquel Salero Toranzo' - 20.02.2012. |